新着記事
オートファジーのメカニズムを解明
東京工業大学率いる研究チームがオートファジー機能について調査し、そのメカニズムを解明しました。オートファジーは、飢餓状態時に生存の為に自己消化し栄養源を確保する機能と理解されている事が多いですが、どのように自己消化をするのかはまだ謎のままでした。
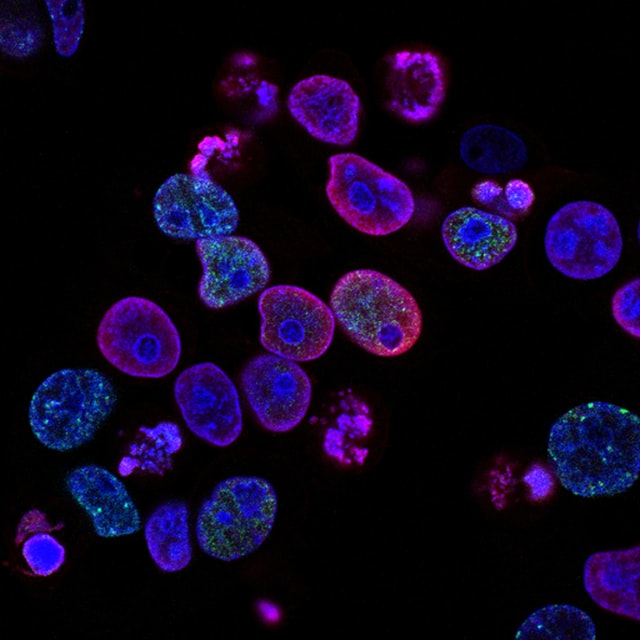
A liquid droplet made of phase-separated proteins (magenta) can associate with autophagy membranes (green). In this paper, it was shown that the droplet-membrane interaction depends on wetting and is defined by the surface tension of the droplet. As autophagy membranes expand on the droplet surface, droplets of sufficiently low surface tension are unable to overcome the intrinsic curvature of the membranes and subsequently deform. This results in a subset of the droplet being ‘bitten off’ by autophagy. The images at the right show this process occurring in a cultured human cell.
参照元:https://www.titech.ac.jp/english/news/2021/048794.html
– 東京工業大学 Tokyo Institute of Technology. January 21, 2021 –
細胞が自分の体液成分をどのように「食べる」か
オートファジーは、細胞が分解とリサイクルのために自身の機能不全または余分な成分を捕捉して分解する基本的な細胞プロセスです。
最近の研究により、相分離した液滴は細胞内でさまざまな重要な機能を持っていることが明らかになりました。
ドイツ、ノルウェー、日本の研究者間の国際協力により、これらの液滴がオートファジーによってどのように捕捉されるか、および液滴が細胞質ゾルのオートファジーを促進する構造が生じるプラットフォームとして機能する方法の両方を支えるメカニズムが解明されました。
人間の健康に重要な役割を果たす重要な細胞内分解経路であるオートファジーは、何十年にもわたって細胞生物学者の注目を集め、2016年のノーベル生理学・医学賞を東京工業大学が授与しました。
このプロセスのメカニズムを明らかにした彼の仕事のために、2016年に大隅良典教授を特別に任命しました。
最近、オートファジーは、相分離によって形成され、急速に進歩する研究において細胞の重要な構造成分として特定されている液滴を分解することが観察されています。
しかし、この液滴の「摂食」がどのように発生するかは不明です。
この単純だが重要な質問により、東京大学のRoland Knorr博士は、ゲッティンゲン(ドイツ)、オスロ(ノルウェー)、東京(日本)の国際的な研究者チームを結成しました。
これには、Institute of InnovateResearchのAlexanderI.May博士も含まれます。
このグループは、オートファゴソームの液滴隔離の生物学的プロセスを理解するために着手し、複雑な物理的メカニズムがオートファジーと液滴の関係の根底にあることを発見しました。
Natureに掲載された彼らの結果は、オートファジーが細胞物質をどのように捕捉するか、および液滴が細胞内でどのように分解されるかについての私たちの理解における大きな進歩を表しています。
これらの発見は、オートファジーおよび神経変性疾患やその他の疾患で観察される飛沫物質の異常な蓄積を対象とした治療研究に情報を提供することを約束します。
オートファジーの最初のステップでは、平らなテニスボールのような形をした二重層の脂質膜で構成されるオートファジーの重要な機能構造である分離膜は、サイズが大きくなり、曲がってカップのような形を形成し、最終的にオートファゴソームとして知られる球状構造になります。
オートファゴソームは、細胞質ゾルおよび液滴などの他の細胞物質を捕捉し、このカーゴを残りのサイトゾルから分離します。
その後、カーゴは分解され、その構成要素は細胞によってリサイクルされます。研究者たちは、驚くほど単純で基本的な物理的原理の観点から理解できることがわかった液滴の分離に焦点を合わせました。
液滴は、液滴の表面積を最小化するように作用する表面張力の影響により球形になります。
液滴が球形からの変形にどれだけ強く抵抗できるかは、液滴の表面張力によって定義され、その値は、液滴と周囲の細胞質ゾルが互いにどれだけ強く反発するかを反映します。
重要なことに、脂質膜は、液滴と細胞質ゾル液の間の界面に位置することができます。
これは、湿潤として知られる現象です。濡れは、膜が液滴およびサイトゾルとの相互作用にどれだけ強いか、および液滴の表面張力に依存します。
研究者たちは、オートファジー膜がどのように液滴と相互作用して捕捉するかを説明するために、これらの物理的な力を説明する理論モデルを開発しました。
彼らは、液滴と分離膜のペアの形状が、液滴の変形に対する抵抗と分離膜が曲がる傾向との間の競合によって支配されることを発見しました。
メイ博士は、物理的な力が液滴分離膜相互作用の結果をどのように決定するかを説明します。
「オートファジーの初期段階では、液滴上の分離膜は小さいため、曲がる傾向は弱いです。膜面積が大きくなるにつれて、ただし、これらの膜は曲がる可能性が高くなり、曲げエネルギーが増加します。液滴の表面張力によって、変形に対する抵抗が決まります。表面張力が十分に低い場合、アイソレーションの曲げエネルギーが液滴の表面張力に打ち勝つ臨界点に到達する可能性があります。この場合、液滴の一部が「噛まれ」、オートファゴソーム内に捕捉されます。この臨界点に到達せず、膜の曲げエネルギーを克服することによって液滴の表面張力がこの競争に「勝つ」場合、分離膜は液滴表面に沿って成長し続け、最終的に液滴全体を飲み込みます。したがって、液滴のオートファジーは、液滴の表面張力と分離膜の曲げエネルギーの間の一種の綱引きと考えることができます。オートファゴソーム内に捕捉されます。この臨界点に到達せず、膜の曲げエネルギーを克服することによって液滴の表面張力がこの競争に「勝つ」場合、分離膜は液滴表面に沿って成長し続け、最終的に液滴全体を飲み込みます。したがって、液滴のオートファジーは、液滴の表面張力と分離膜の曲げエネルギーの間の一種の綱引きと考えることができます。そして、オートファゴソーム内に捕捉されます。この臨界点に到達せず、膜の曲げエネルギーを克服することによって液滴の表面張力がこの競争に「勝つ」場合、分離膜は液滴表面に沿って成長し続け、最終的に液滴全体を飲み込みます。したがって、液滴のオートファジーは、液滴の表面張力と分離膜の曲げエネルギーの間の一種の綱引きと考えることができます。」
「断片的」オートファジーと「完全」オートファジーの間のこのトレードオフを予測するモデルを使用して、チームは生細胞でこれらの発見を確認することに着手しました。
研究者らは、蛍光顕微鏡法と電子顕微鏡法の最先端の組み合わせを使用して、p62またはSQSTM1と呼ばれるタンパク質を濃縮する液滴コンパートメントを追跡しました。
低表面張力の液滴条件のモデリングによって予測されたように、液滴表面への小さな分離膜の局在化の後に、液滴の断片の「噛み付き」が続いた。
しかし、チームは、液滴の特性が隔離に及ぼす影響を確認するために、液滴の表面張力を制御する革新的な手段を開発する必要がありました。
この質問に対処するために、研究者たちは細胞内環境の複雑さを排除する最小限の合成実験システムを考案しました。
このアプローチを使用して、彼らは、高い表面張力を有する液滴の表面上の既存の膜からの分離膜様構造の自己組織化を観察した。
この実験装置の調整可能な性質により、研究者は液滴の表面張力を低下させることができ、それによってこれが液滴の捕捉にどのような影響を与えるかをテストすることができました。
モデルによって予測されたように、彼らは、平らにされた分離膜が中間のカップのような形状を介してオートファゴソームのような構造に変化し、それによって液滴から噛み付くことを観察しました。
一緒に、これらの結果はモデルの信憑性を確認し、濡れが液滴でのオートファゴソーム形成を支配する物理的メカニズムであることを示しています。
これらの結果は、オートファジーにおける相分離の重要性に関して、生物学者がまだ氷山の一角のみを調査していることを示しています。
興味深いことに、2020年にNatureで発表された、大隅博士、Knorr博士、May博士の共著による別の研究では、酵母細胞のオートファゴソーム形成部位は実際には決して捕捉されない液滴であることが示されました。
Knorr博士は話します。
「液滴が新しい重要なオートファジー構造であることを発見することに非常に魅了されました。ここで、p62などのオートファゴソームによって分解される液滴の種類もあれば、そうでないものもあるという観察の背後にあるメカニズムを理解したいと思いました。」
上記の分離膜の曲げと液滴表面張力の間の単純な競合は、分離膜が液滴表面に付着したときに分離膜の特性が変化しないことを前提としています。
液滴オートファジー中に分離膜の各側が2つの非常に異なる流体(液滴またはサイトゾル)を濡らすため、これは起こりそうにありません。
チームはこれを説明するためにモデルを拡張し、分離膜のそのような濡れに由来する固有の非対称性が曲げ方向を決定し、それによって分解のために捕捉された材料を発見しました。
断片経路を介した液滴、または分離の成長を介したサイトゾル液滴から離れた膜の組み合わせでできた材料です。
これをテストするために、研究者らは、分離膜のタンパク質と相互作用することが知られている特定のモチーフを欠くようにp62タンパク質を改変し、それによって分離膜と液滴の結合を弱めました。
この操作には根本的な効果がありました。野生型(未修飾)細胞では、分離膜がp62液滴に沿って成長することが最初に観察されましたが、代わりに細胞質ゾルを捕捉するために曲がり、液滴を完全に無傷のままにしました。
したがって、飛沫特性のわずかな変化は、生細胞のオートファジーのモードに重大な影響を及ぼし、飛沫の断片的または完全な囲い込み、さらには細胞質ゾル物質の捕捉さえも特定します。
この切り替えを可能にする根本的な物理的根拠の解明は、オートファジーのメカニズム、液滴の役割、および細胞内での濡れなどの物理的原理の理解において、まったく新しい視点を提供します。
この理解は、細胞生物学における物理的力の影響に関する多くの新しい研究の基礎を築くとともに、神経変性疾患や癌など、治療が容易ではない疾患にオートファジーがどのように関与しているかを理解するのに役立つ新しい手がかりを提供します。

この記事が気に入ったら
いいね または フォローしてね!
関連記事
新着記事
-

 男女ともに長生きになる「男女平等」2023.03.07健康
男女ともに長生きになる「男女平等」2023.03.07健康 -

 他者を犠牲にして利益を取る・利益を度外視して他者への害を取り除く2023.03.06人体・脳
他者を犠牲にして利益を取る・利益を度外視して他者への害を取り除く2023.03.06人体・脳 -

 「寿命を延ばす」良質な睡眠2023.03.05健康
「寿命を延ばす」良質な睡眠2023.03.05健康 -

 見極める力を養う「チャットボットの精度」2023.03.04技術
見極める力を養う「チャットボットの精度」2023.03.04技術 -

 健康増進と生きがいにつながる「森林浴」2023.03.03健康
健康増進と生きがいにつながる「森林浴」2023.03.03健康 -

 米国の6人に1人「肥満による死」2023.03.02健康
米国の6人に1人「肥満による死」2023.03.02健康 -

 週休4日制で生産を維持する2023.03.01社会
週休4日制で生産を維持する2023.03.01社会 -

 オンライン学習で学生に届く教育方法2023.02.28学習
オンライン学習で学生に届く教育方法2023.02.28学習 -

 学業成績に影響を与える「夜間の睡眠」2023.02.27健康
学業成績に影響を与える「夜間の睡眠」2023.02.27健康 -

 心の豊かさに大きく影響を与える「目的意識を持った10代の若者」2023.02.26健康
心の豊かさに大きく影響を与える「目的意識を持った10代の若者」2023.02.26健康
よく読まれている記事
-

 なぜタイピングより手書きの方が、記憶に定着するのか
なぜタイピングより手書きの方が、記憶に定着するのか -

 どんな曲が好き?「 音楽の好みと性格の関連性は普遍的 」
どんな曲が好き?「 音楽の好みと性格の関連性は普遍的 」 -

 視覚と意思決定領域の結びつきが強い「鮮明なイメージ能力がある人」
視覚と意思決定領域の結びつきが強い「鮮明なイメージ能力がある人」 -

 「触覚が敏感な部位はなぜあるのか」触覚メカニズムが解明される
「触覚が敏感な部位はなぜあるのか」触覚メカニズムが解明される -

 不活性化されたリチウムイオン電池を甦えさせる「復活するリチウムイオン電池」
不活性化されたリチウムイオン電池を甦えさせる「復活するリチウムイオン電池」 -

 記憶が脳に保存される新しい理論「MeshCODE理論」が開発される
記憶が脳に保存される新しい理論「MeshCODE理論」が開発される -

 大面積有機フォトダイオードに置き換わる?「シリコンフォトダイオード技術」
大面積有機フォトダイオードに置き換わる?「シリコンフォトダイオード技術」 -

 幸福度を7%上げる「旅行の仕方」
幸福度を7%上げる「旅行の仕方」 -

 「世界最長寿記録を更新し132歳まで生きる人が出現する」ベイズ統計学予測
「世界最長寿記録を更新し132歳まで生きる人が出現する」ベイズ統計学予測 -

 組織の中で行われたインシビリティ(非礼な言動)を軽視してはいけない理由
組織の中で行われたインシビリティ(非礼な言動)を軽視してはいけない理由
N E W S & P O P U L A R最 新 記 事 & 人 気 記 事
WHAT'S NEW !!
-






男女ともに長生きになる「男女平等」
【男女ともに長生きになる「男女平等」】 権利とは人間が作り出した構造ですが、男女平等が進むと男女ともに長生きになるようです。 The first global study to investi... -






他者を犠牲にして利益を取る・利益を度外視して他者への害を取り除く
【他者を犠牲にして利益を取る・利益を度外視して他者への害を取り除く】 他者を犠牲にして自分の利益を選ぶ、自分にとって利益は少ないが他者への害を防ぐ、道徳的なに... -






「寿命を延ばす」良質な睡眠
【「寿命を延ばす」良質な睡眠】 良質な睡眠をとることは、寿命を何年も長くする可能性があります。 Getting good sleep can play a role in supporting your heart and... -






見極める力を養う「チャットボットの精度」
【見極める力を養う「チャットボットの精度」】 ChatGPTをはじめ、チャットボットの精度は人が書いたものかどうかわからない程までの水準になっています。 The most rec...
-






なぜタイピングより手書きの方が、記憶に定着するのか
【なぜタイピングより手書きの方が、記憶に定着するのか】 ノルウェー科学技術大学の研究によると、手書きの方が物事をよく覚えることが判明しました。 様々なコンピュ... -






どんな曲が好き?「 音楽の好みと性格の関連性は普遍的 」
【どんな曲が好き?「 音楽の好みと性格の関連性は普遍的 」】 激しい音楽を好んで聴く人は、激しい性格の持ち主なのでしょうか?研究者は、音楽の好みと性格の関連性は... -






視覚と意思決定領域の結びつきが強い「鮮明なイメージ能力がある人」
【視覚と意思決定領域の結びつきが強い「鮮明なイメージ能力がある人」】 鮮明にイメージできる人は、視覚ネットワークと意思決定に関連する脳の領域が強く結びついてい...
News
- 新着記事 -
Popular
- 人気記事 -
H A P P I N E S S幸 福
人気 (❁´ω`❁)
M E A L食 事
B R A I N脳
人気 (❁´ω`❁)
H E A L T H健 康
人気 (❁´ω`❁)
-






人体・脳
健康な脳を保ち老化を遅らせる「アマゾンの先住民族ツィマネ族の生活習慣」
【健康な脳を保ち老化を遅らせる「アマゾンの先住民族ツィマネ族の生活習慣」】 ボリビア・アマゾンの先住民族であるツィマネ族が、アメリカやヨーロッパの人々に比べて... -






社会
自制心が健康と若さをもたらす理由
【自制心が健康と若さをもたらす理由】 デューク大学の研究チームは、自制心が心身に及ぼす影響を調査しました。 1000人を出生から45年間に渡って追跡した大規模調査で... -






健康
高強度インターバルトレーニングは、適度な運動よりも心臓を強化する
【心臓を強化する高強度インターバルトレーニング】 ノルウェー科学技術大学の研究によると、トレーニングの強度が、病気の重症度を軽減し、心臓機能を改善し、作業能力...
-






人体・脳
健康な脳を保ち老化を遅らせる「アマゾンの先住民族ツィマネ族の生活習慣」
【健康な脳を保ち老化を遅らせる「アマゾンの先住民族ツィマネ族の生活習慣」】 ボリビア・アマゾンの先住民族であるツィマネ族が、アメリカやヨーロッパの人々に比べて... -






社会
自制心が健康と若さをもたらす理由
【自制心が健康と若さをもたらす理由】 デューク大学の研究チームは、自制心が心身に及ぼす影響を調査しました。 1000人を出生から45年間に渡って追跡した大規模調査で... -






健康
高強度インターバルトレーニングは、適度な運動よりも心臓を強化する
【心臓を強化する高強度インターバルトレーニング】 ノルウェー科学技術大学の研究によると、トレーニングの強度が、病気の重症度を軽減し、心臓機能を改善し、作業能力...
J O B仕 事
人気 (❁´ω`❁)
-






社会
週休4日制で生産を維持する
-






人体・脳
アイデアや閃きが降りてくる「横断的なコミュニケーション」
-





社会
大災害を読み解く鋭い解決策
-






思考・瞑想
賞や表彰が発明家の創造性を低下させる
-






人体・脳
創造的な人はここが違う!「非創造的なハブを回避し非典型的なアプローチをする」
-






社会
アメリカ陸軍で既に多数の成功を収めている「人々を創造的にするトレーニング」
-






社会
2年は普及しない?「カテゴリーイノベーション戦略」
-






社会
管理者級以上必見「創造性を引き出す同僚間の友情とサポートを育む組織づくり」
-






社会
アイデアを創出する人数「少人数のグループのほうが新しいアイデアが出やすい」
-






健康
散った気を元の集中に戻す「1日最大50%費やす迷いを断つマインドフルネス」
-





社会
移動によるエネルギーが激減「環境に優しく誰でも参加できるオンライン会議」
-






社会
山火事コスト数十億ドルのコスト削減「インドネシアの泥炭地回復」
-






社会
価格末「99円」設定が販売者に不利益を及ぼす驚愕の理由
-






社会
購買意欲を掻き立てる商品提示方法
-






社会
「感情的異質性」がチームの創造性を高める
-






社会
従業員の創造性を高める驚愕の方法「報酬を選択制にする」
-






社会
テクノロジーの力でセレンディピティを生み出す
-






社会
様々なテーマの問題への取り組みにつながる「ダ・ヴィンチ構想」
-






社会
改善が必要な状況に「やめる」という解決策がでない理由
-






社会
空想が苦手な理由と、その修正方法
-






学習
パズル解きの極意、最良の選択より優れた驚愕の方法
-






社会
大麻が独創的で実現不可能なアイデアを創出するという実験結果
-






社会
記憶に残るユーモアを含んだニュース
-





社会
なぜメッセージと画像が一致してない情報は伝わらないのか
-






社会
消費者を購買に結びつける音楽
-






技術
自動化工場などの緊急事態に備えて知識を生かしておく方法
-






社会
「生産性も顧客満足度も向上」プロジェクトに自主性を持たせる
-






人体・脳
人は1日に35,000回の意思決定をしている「意思決定を行うアルゴリズム」
-






社会
他文化と頻繁衝突する文化圏は協力的なゲームが流行?「ゲームからみる文化」
-






社会
「通勤はわるいもの?」モバイルセンシングで仕事の成果と通勤の関連性を解明
-






社会
テクノロジーは労働者の幸福度にどのような影響を及ぼすか
-






社会
雇用の創出ではなく雇用の置換が進む「ロボットなどの作業の自動化」
-






社会
「柔軟で弾力性のある対応が可能」生物系を模倣した多様なサプライチェーン
-






社会
「患者のメンタルヘルスケアを向上させる」患者と心理療法士のマッチング
-




学習
デジタルデバイス用に最適なフォント「AdaptiFont」
T E C H N O L O G Y技 術
人気 (❁´ω`❁)